Inscrivez-vous ou connectez-vous pour rejoindre votre communauté professionnelle.

أولا: بشكل عام لا ينبغي على الإطلاق ربط خواص المركبات بخواص العناصر المكونه لها، لأنه أثناء التفاعلات تتغير الروابط بين ذرات هذه العناصر و الأمثلة عديدة، أشهرها المثال الذي تفضلت بذكره في سؤالك و هو أن الهيدروجين يشتعل بفرقعة و الأكسجين أساسي لجميع عمليات الإشتعال و لكن بمفاعلتهم سويا تتغير الزوايا بين الروابط بل و تتكون روابط جديدة كما تتغير بنية الأوربيتالات مغيرة شكل السحابة الإليكترونية حول كل ذرة و بالتالي تتغير خواص المركب الناتج.
هناك مثال أخر شهير و هو عند خلط برادة الحديد مع الكبريت على البارد، يظل الحديد قابلاً للإنجذاب للمغناطيس بشكل يمكننا من فصله عن الكبريت تماماً؛ و لكن عند تسخين الحديد مع الكبريت تتكون مركبات أخرى لا تنجذب للمغناطيس. و بذلك نتأكد أنه لا يشترط أن يكون المركب الناتج بنفس خواص العناصر المكونه له.
ثانيا: بالنسبة لسؤالك، التعريف الكيميائي للإشتعال: هي عملية أكسدة سريعة (أي تفاعل مع الأكسجين) تفقد فيها الذرات جزء من طاقتها في صورة ضوء و حرارة (و اللهب الذي نراه ما هو إلا الطاقة الناتجة من انتقال الإلكترونات لمستويات طاقة أقل) و بعد تمام التفاعل تصبح المادة المحترقة في حالة أكثر استقراراً و أكثر تشبعاً بالأكسجين لذلك لا تشتعل مرة أخرى.
الخشب مثلاً قابل للإشتعال (و هو مركب بشكل أساسي من كربون و هيدروجين) و لكن عملية الإشتعال ينتج عنها أكسدة الكربون إلى ثاني أكسيد الكربون و أكسدة الهيدروجين إلى أكسيد الهيدروجين (أي الماء!) و كلاهما غير قابل للإشتعال لأنهما مشبعان بالفعل بالأكسجين؛ حتى أن الرماد الناتج من الإحتراق يكون غير قابل للإشتعال ؛ ببساطة لأن المادة لم يعد لديها طاقة تفقدها في صورة لهب
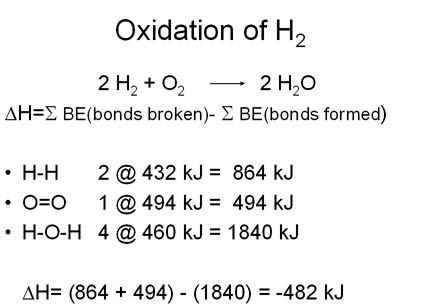
و عند إحتراق غاز الهيدروجين وحده فإنه يتأكسد إلى أكسيد الهيدروجين (أي الماء!) و نظراً لأن الماء هو ناتج تفاعل الإحتراق فهو مستقر ومشبع بالأكسجين لذلك لا يتأكسد (أي لا يحترق!). و تسري هذه القاعدة على أي نواتج عملية أكسدة (خلاف الماء و ثاني أكسيد الكربون!) فسبحان الخلاق الذي خلق الشيء و نقيضه من نفس الأصل
لوجود نوعين من الروابط الاولى بين ذرة الاكسجين و ذرة الهيدروجين فى جزىء الماء وهى من النوع التساهمى القطيى والنوع الثانى من الروابط تتكون بين ذرة اكسجين فى جزىء وذرة هيدروجين فى جزىء آخر وتسمى بالرابطة الهيدروجينية وهى اقوى انواع الروابط الافتراضية ...هذين النوعين ون الروابط تمنع الاكسجين والهيدروجين من الانفصال فى الظروف العادية

ذلك بسبب نوع الروابط بينهما والتى تفقد الذرتين خواصهما عند الاندماج فيما بينهما

لان عناصر في الجدول الدوري خواصها وصفاتها الكيميائية تختلف كليا عن ما اذا كانت مشتركة في مركب التي تكونت منها يعني عنصر ما في حالة نقية لها صفات تفاعلية خاصة بها وعندما تشترك في تكوين مركب صفات وخواص العنصر سيختلف اعتمادا وتتكيف مع عنصر الذي اشتركت معا في تكوين مركب فمثلا الهيدروجين وحده كعنصر فعال ولكن عندما يشترك مع اوكسجين يكون مركب مستقر وايضا بنسبة للكلور وصوديوم فكلور في حالة غازية فعالة لانها تمتلك جذر حر الكتروني تستطيع ان تهبه وصوديوم فعال لانه لها اوربيتال فارغ بحاجة للكترونات وبتالي يكونان مركب كلوريد صوديوم ملح طعام وهي مادة مستقرة جدا في ظروف الاعتيادية الى اقصى الحدود مقارنة مع العنصران الذان تكونتا منها ومعروف بصفاتها الشديدة الفعالية



